ケトン体とは

ケトン体の化学式
α(アルファ)位にカルボン酸
β(ベータ)位に水酸基
β(ベータ)位の炭素は不斉炭素であり立体異性体を生じ、生物はD体のみを生産。
酪酸の誘導体であり、有機酸の一種。
ミトコンドリアのエネルギー基質である。
ケトン体(正式名/βヒドロキシ酪酸)は、食材にも含まれていますが、
中性脂肪を原料として肝臓が作り出すものでもあります。
通常人間の体は食事で摂取した糖類を分解してエネルギー源として使いますが、
それがなくなると体内の脂肪を分解し、ケトン体を生成するようにできています。
ケトン体は、有機酸というグループに属しβ位に水酸基があることが特徴ですが、
この水酸基があると水溶性が大きくなります。すなわち高濃度で血液に溶けたまま体内を循環できるのです。
生理的な役割は「エネルギー基質」と呼ばれるもので、肝臓において脂肪から合成されて血液循環に入り、骨格筋などで完全酸化され、細胞内のエネルギー通貨であるアデノシン3-リン酸(ATP)に変換され、種々の生理作用に消費されるのです。
近年のケトン体再評価
ケトン体は物質としては百年以上前から発見されていましたが、その生理作用の実態がわかり始めたのはここ20年のことです。その間に研究者の間で論文も数えきれないくらい出され、ケトン体のさまざまな効力に関しての高い評価が継続してきました。ここでは、その中でも特に興味深い二つの事柄を取り上げます。まず、ケトン体は他の有機酸とは異なり細胞膜に特異的な受容体が存在する、という事です。ケトン体の受容体として主に提案されているのは以下の2つです。
HCR2
(エイチカーツー)
HCAR2の発見によって、ケトン体は他の有機酸とは異なる特別な生理作用を持つ分子として認知されるようになりました。HCAR2は水酸基を持つ有機酸により活性化することができますが、特にケトン体において強い活性化がみられ、抗炎症作用や脂肪分解など多くの生理活性に関与しています。(*参考文献 1)
GPR43
(ジーピーアール43)
ケトン体が増えることによっておこる最も顕著な生理作用は脂肪の分解です。
これには特別な受容体が存在するのではないかと多くの研究者が考えていましたが、昨年(2019年9月)にGPR43というタンパク質であることが突き止められました。糖質を制限するとケトン体濃度が増加しGPR43が活性化するため脂肪が優先的に分解されるのです。(*参考文献 2)
(*参考文献 1) Graff EC, Fang H, Wanders D, Judd RL. Anti-inflammatory effects of the hydroxycarboxylic acid receptor 2. Metabolism. 2016 Feb;65(2):102-13. doi: 10.1016/j.metabol.2015.10.001. Epub 2015 Nov 13. PMID: 26773933.
(*参考文献 2) Miyamoto J, Ohue-Kitano R, Mukouyama H, Nishida A, Watanabe K, Igarashi M, Irie J, Tsujimoto G, Satoh-Asahara N, Itoh H, Kimura I. Ketone body receptor GPR43 regulates lipid metabolism under ketogenic conditions. Proc Natl Acad Sci U S A. 2019 Nov 19;116(47):23813-23821. doi: 10.1073/pnas.1912573116. Epub 2019 Nov 4. PMID: 31685604; PMCID: PMC6876247.
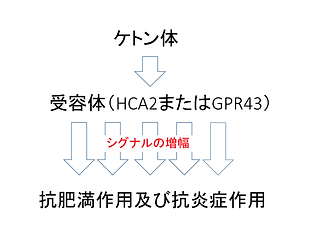
ケトン体が、免疫細胞のHCAR2や脂肪細胞のGPR43などの受容体タンパク質に結合すると、免疫細胞や脂肪細胞内のシグナルを増幅します。細胞内のシグナルを増幅することで、炎症反応を抑制したり、脂肪の合成を抑制したりする、ということが論文により提案されています。
最後に、論文を紹介します。
これは、ケトン体に関する今年(2020年)の論文です。
実験でケトン体を神経細胞にかけると、Aベータ―(認知症の原因物質)が減ることを示しています。
β-Hydroxybutyrate Ameliorates Aβ-Induced Downregulation of TrkA Expression by Inhibiting HDAC1/3 in SH-SY5Y Cells.
Li X, Zhan Z, Zhang J, Zhou F, An L.Am J Alzheimers Dis Other Demen. 2020 Jan-Dec;35:1533317519883496. doi: 10.1177/1533317519883496. Epub 2019 Oct 24.PMID: 31648544 Free article.
Tyrosine kinase receptor A (TrkA) plays an important role in the protection of cholinergic neurons in Alzheimer's disease (AD). This study was designed to investigate whether β-hydroxybutyrate (BHB), an endogenous histone deacetylase (HDAC) inhibitor, …
以下の論文は、ケトン体がHDACを抑制して酸化ストレスから保護する、という有名な論文です。
Suppression of Oxidative Stress by β-Hydroxybutyrate, an Endogenous Histone Deacetylase Inhibitor.
Shimazu T, Hirschey MD, Newman J, He W, Shirakawa K, Le Moan N, Grueter CA, Lim H, Saunders LR, Stevens RD, Newgard CB, Farese RV Jr, de Cabo R, Ulrich S, Akassoglou K, Verdin E.
Science. 2013 Jan 11;339:211-214.
この研究では、ケトン体であるβ-ヒドロキシ酪酸 (β-Hydroxybutyrate ; βOHB)が、内因性の class Iヒストン脱アセチル化酵素 (histone deacetylases; HDACs)阻害物質であることを報告している。マウスにβOHBを投与したり、絶食またはカロリー制限により内因性βOHBを増加させたりすると、腎組織のヒストンアセチル化は全体的に増加した。また、βOHBによるHDAC阻害により、酸化ストレス耐性をコードする遺伝子(FOXO3A、MT2など)の転写が増加した。HEK293細胞にβOHBを添加すると、Foxo3aとMt2プロモーターのヒストンアセチル化が増加し、どちらの遺伝子発現もHDAC1とHDAC2の選択的欠損によって活性化された。βOHB を投与したマウスは、FOXO3AとMT2活性増加に伴って、酸化ストレス(パラコートによる蛋白カルボニル化など)に対する耐性が認められた。
【結論】
βOHBは内因性のHDAC阻害物質であり、絶食やカロリー制限によるmM単位の濃度増加で組織にエピジェネティックな変化(ヒストンアセチル化の増加)を起こして、酸化ストレス耐性遺伝子(Foxo3aなど)の発現を増加させることにより、生体の酸化ストレス耐性をもたらすことが明らかになった。以前より、低炭水化物食によるケトン体産生によって神経の酸化ストレス障害耐性がもたらされること(neuroprotectiveな効果)が知られていた。本研究の結果から、ケトン体産生食(ketogenic diets)やカロリー制限による効果は、βOHBのHDAC阻害効果を介しているのかもしれないと考えられた。